
肥胖影响着全球数以百万计的人。肠道微生物群影响脂肪积累,但其机制尚待研究。在此,作者在一个大型中国纵向队列中展示了血清中微生物芳香族氨基酸代谢产物与脂肪积累之间的相关性。接下来,作者发现4-羟基苯乙酸(4HPAA)及其类似物能有效保护雄性小鼠免受高脂饮食诱导的肥胖。这些代谢产物作用于肠黏膜,调节免疫反应并控制脂质吸收,从而防止肥胖。作者进一步证明,T细胞和B细胞对于4HPAA介导的肥胖预防并非至关重要,而天然淋巴细胞则具有拮抗作用。这些发现共同揭示了特定微生物代谢产物作为关键分子,通过免疫调控来阻止肥胖,从而建立了宿主通过肠道微生物代谢产物调节的机制。
1、微生物芳香族氨基酸(AAA)代谢与人体脂肪含量相关。
研究团队以一个中国人群的大型健康队列(广州居民营养与健康队列,GNHS)为基础,通过整合定量化的血清代谢组学与人体测量学数据,系统筛选出与肥胖表型密切相关的代谢物。在芳香族氨基酸(AAA)代谢途径中,七种分子表现突出:4-羟基苯乙酸(4HPAA)、苯丙氨酸(Phe)、酪氨酸(Tyr)、马尿酸、5-羟色氨酸和色氨酸(Trp)与肥胖呈负相关,而4-羟基苯丙酮酸与肥胖呈正相关(图1b、c)。4HPAA是与全身脂肪百分比呈负相关的最主要血清代谢产物(图1b),并且与不同身体区域(包括躯干、男性型和女性型区域)的脂肪百分比也呈负相关。代谢网络动态分析揭示其上游前体分子呈现正向关联特征,而下游代谢产物未显示统计学关联,提示该分子在微生物-宿主共代谢过程中可能发挥独特的生物学调控功能(图1)。
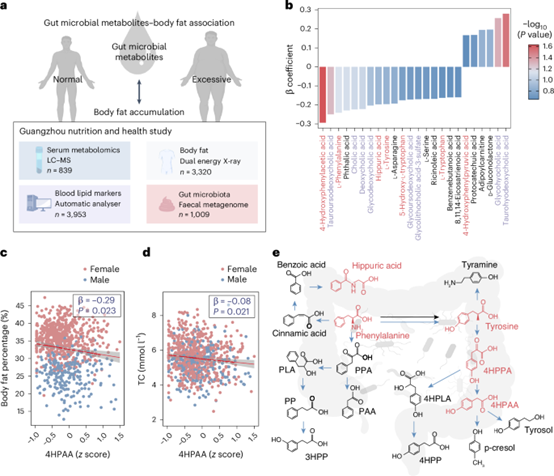
图1. 肠道细菌的芳香族氨基酸代谢物与人体肥胖指征有相关性
2、 口服4-羟基苯乙酸(4HPAA)、3-羟基苯丙酸(3HPP)和4-羟基苯丙酸(4HPP)可减少小鼠的体重增加。
4-羟基苯乙酸(4HPAA)可能是一种能够抑制体重增加的生物活性分子,为了验证这一点,作者使用了高脂饮食诱导肥胖的小鼠模型。实验显示饲喂4HPAA的干预组较对照组体脂蓄积显著降低。更有意思的是,两种与4HPAA具有相似化学结构的小分子代谢物3HPP和4HPP也能起到类似预防肥胖的效果。

图2:口服4-羟基苯乙酸(4HPAA)、3-羟基苯丙酸(3HPP)或4-羟基苯丙酸(4HPP)可抑制高脂饮食(HFD)喂养小鼠的体重增加。
3、4HPAA 减轻脂肪细胞肥大和脂肪肝
由于4-羟基苯乙酸(4HPAA)、3-羟基苯丙酸(3HPP)和4-羟基苯丙酸(4HPP)显著抑制了脂肪积累,作者通过组织学分析评估了这些分子对不同脂肪组织的影响。从高脂饮食(HFD)喂养的小鼠中分离出肩胛间棕色脂肪组织(iBAT)、腹股沟白色脂肪组织(iWAT)和附睾白色脂肪组织(eWAT),将其切片、用苏木精-伊红(H&E)染色,并在显微镜下观察。正如预期的那样,高脂饮食喂养小鼠的iBAT、iWAT和eWAT中的脂肪细胞比正常饮食喂养小鼠的脂肪细胞更大。这种脂肪细胞肥大是肥胖的典型表型。相比之下,经过4HPAA、3HPP或4HPP处理的高脂饮食喂养小鼠的脂肪细胞更小,更接近于正常饮食喂养小鼠的脂肪细胞,而酪醇处理的小鼠则没有这种效果(图3a-c)。对这些小鼠肝脏切片的组织学分析显示,4-羟基苯乙酸(4HPAA)、3-羟基苯丙酸(3HPP)和4-羟基苯丙酸(4HPP)均能有效缓解高脂饮食(HFD)诱导的脂肪肝,而酪醇则没有保护作用(图3d、e)。
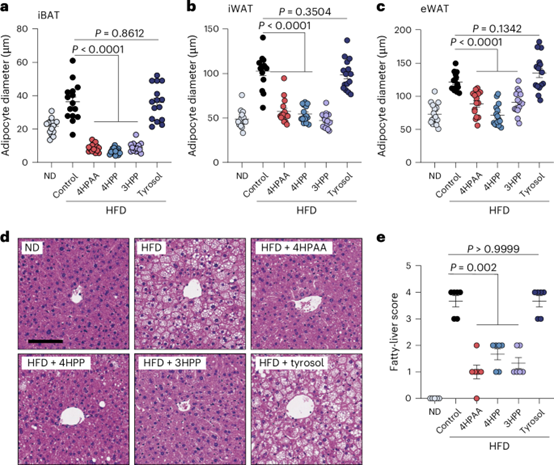
图3:这些肠道菌群代谢产物减轻脂肪细胞肥大和脂肪肝。
4、4HPAA 和 3HPP 喂养小鼠的代谢特征
为了探究在高脂饮食(HFD)条件下,摄入芳香族氨基酸(AAAs)及其相关代谢产物的小鼠为何比对照小鼠更瘦,第12周,作者测量了小鼠的能量消耗。4HPAA和3HPP喂养的小鼠仅表现出略高于肥胖对照小鼠的代谢消耗(图4b-d),这无法解释体重增加的减少。接下来,作者测量了小鼠粪便中的热量含量。4HPAA、3HPP和4HPP喂养小鼠的粪便热量高于对照小鼠(图4e),这表明4HPAA、3HPP和4HPP损害了高脂饮食喂养小鼠的营养吸收。同时,在12周后,给予4HPAA、4HPP或3HPP的小鼠在两项试验中均表现出更低的血糖水平(图4f、g)。
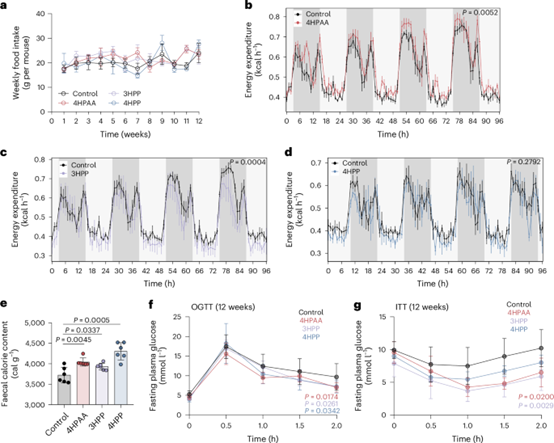
图4 4HPAA 和 3HPP 喂养小鼠的代谢特征
5、4-羟基苯乙酸(4HPAA)和3-羟基苯丙酸(3HPP)靶向肠道。
接下来,作者研究了口服的代谢产物是作用于肠道,还是进入循环系统以靶向远端器官(如肝脏和脂肪组织)。为此,作者对高脂饮食(HFD)喂养的小鼠每周两次腹腔注射4-羟基苯乙酸(4HPAA)或3-羟基苯丙酸(3HPP)(图5a)。通过腹腔注射,这些化合物绕过了肠道上皮细胞,而是通过门静脉被吸收,首先到达肝脏,然后在全身循环。有意思的是,即使给予更大剂量,腹腔注射也无法达到预防肥胖的效果,预示这些小分子代谢物的作用部位是肠道上皮(图3),肠道很可能是这些化合物发挥抗肥胖保护作用的关键部位。
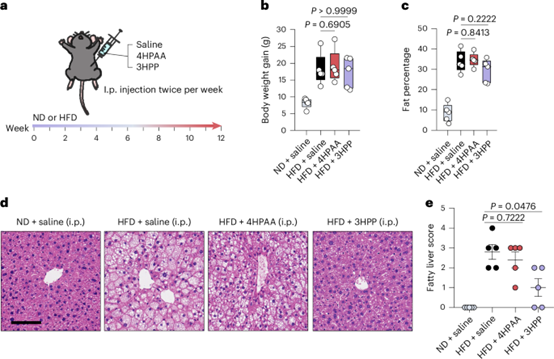
图5 4-羟基苯乙酸(4HPAA)和3-羟基苯丙酸(3HPP)通过靶向肠道来实现最佳的抗肥胖效果。
6、图6:4-羟基苯乙酸(4HPAA)和3-羟基苯丙酸(3HPP)独立于肠道微生物群预防肥胖。
接下来,作者研究了这些代谢产物是否通过改变肠道微生物群来实现其抗肥胖效果,因为肠道微生物群是调节体重增加的重要因素。作者通过无菌小鼠模型开展机制验证。结果表明,在肠道微生物缺失条件下,虽然差异变小,但饲喂了代谢物的干预组相较对照组仍可抑制小鼠肥胖的相关表型。该实验证明该代谢小分子可以直接作用于宿主进行调控,而非间接通过其它肠道微生物的介导作用来发挥功效。
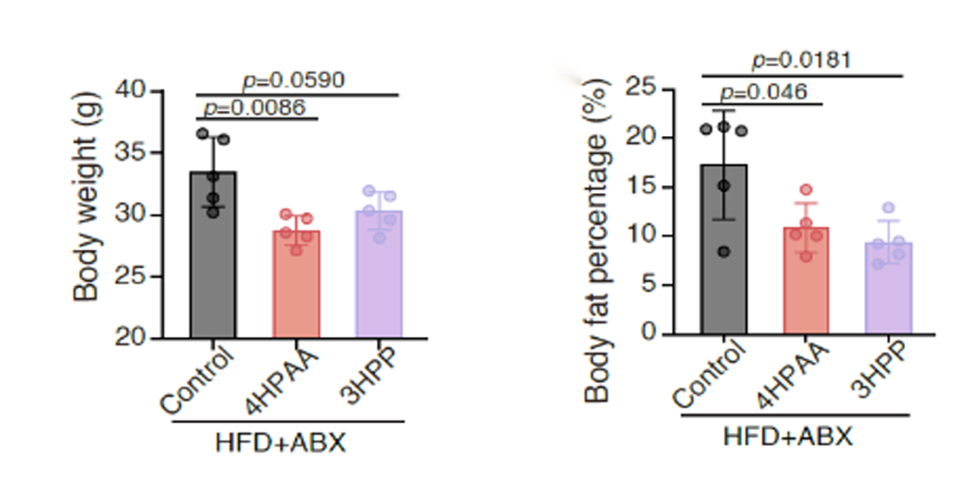
图6 4HPAA和3HPP可不依赖于肠道菌群发挥作用
7、4-羟基苯乙酸(4HPAA)喂养抑制慢性炎症。
为了了解这些芳香族氨基酸(AAAs)及其相关代谢产物如何在肠道中发挥作用以预防肥胖,作者比较了经过3个月4HPAA处理和对照组的高脂饮食(HFD)喂养小鼠的肠道组织转录组。RNA测序(RNA-seq)结果显示,在结肠组织中,有42个转录本上调,64个转录本下调,且变化倍数超过两倍(图7a)。基因集富集分析显示,涉及脂质代谢的途径,包括单羧酸代谢、脂肪酸代谢、甘油三酯代谢、脂肪酸代谢和脂质氧化等途径受到抑制(图7b)。组织学分析显示4HPAA饲喂小鼠的肠道慢性炎症水平相较对照组显著降低(图7c、d)。
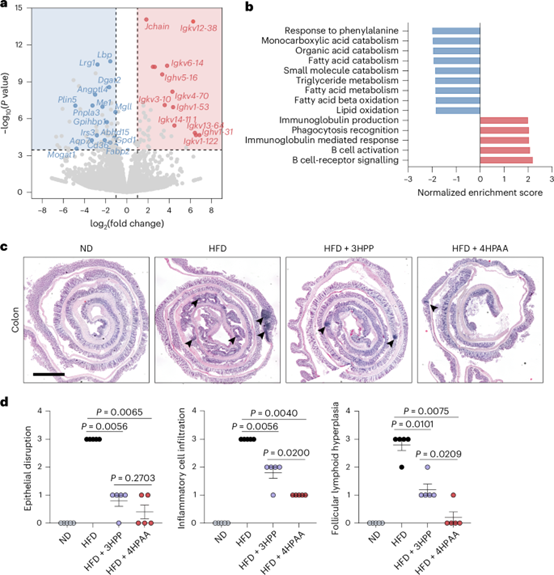
图7:4-羟基苯乙酸(4HPAA)处理减轻结肠上皮的慢性炎症
8、4-羟基苯乙酸(4HPAA)和固有淋巴细胞(ILCs)在调节体重增加方面具有拮抗作用
4-羟基苯乙酸(4HPAA)和固有淋巴细胞(ILCs)在调节体重增加方面具有拮抗作用。在4HPAA处理的小鼠中,所有三种固有淋巴细胞(ILC)亚群均有所减少。进一步的免疫缺陷小鼠实验表明,T细胞和B细胞并非4HPAA介导的肥胖预防的关键细胞,而缺失ILCs的小鼠中,4HPAA饲喂干预效果发生了明显变化, ILCs和4HPAA可能通过拮抗调节共同靶向某些细胞(如髓系细胞),从而控制高脂饮食(HFD)诱导的体重增加。
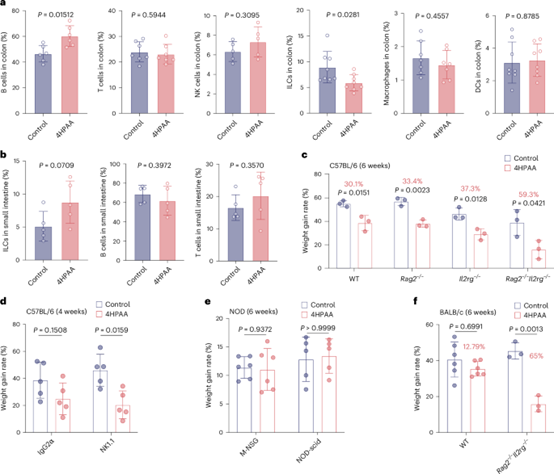
图8:4-羟基苯乙酸(4HPAA)通过免疫调控调节体重增加。
本研究填补了关于肠道微生物代谢产物与肥胖关系方面的一个重大知识空白,揭示了肠道微生物群如何通过依赖代谢的免疫调控来调节宿主生理。发现具有抗慢性肠炎活性的微生物芳香族氨基酸(AAAs)及其相关代谢产物,对于开发肥胖及相关代谢紊乱的新预防策略和治疗方法具有重要价值。
参考文献
Jiang Z, He L, Li D,et al. Human gut microbial aromatic amino acid and related metabolites prevent obesity through intestinal immune control. Nat Metab. 2025 Mar 14. doi: 10.1038/s42255-025-01246-5.